|
| ||||||||
|
| |||||||
|
1.3.Потенциал действия
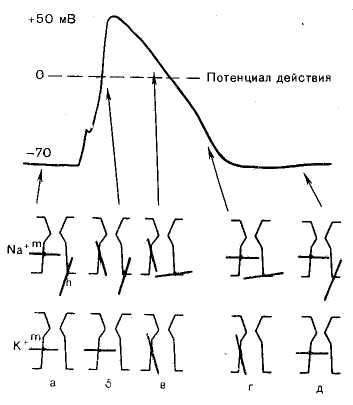
При возбуждении нервных, мышечных и других возбудимых клеток возникает потенциал действия (ПД), представляющий собой быстрое колебание мембранного потенциала, связанного с изменением ионной проницаемости мембраны (рис. 1.3).
Рис. 1.3. Потенциал действия
Величина ПД колеблется в пределах 80–130 мВ, длительность пика ПД нервного волокна – 0,5–1 мс, волокна скелетной мышцы – до 10 мс, длительность ПД сердечной мышцы – 300–400 мс. Потенциал действия возникает при действии пороговой силы раздражения. Амплитуда ПД не зависит от силы вызывающего его раздражения. Наличие порога и независимость амплитуды ПД от силы вызвавшего его стимула получили название закона "все или ничего". Подпороговое раздражение может вызвать локальный потенциал. Он подчиняется закону силы: с увеличением силы стимула величина его также возрастает. Локальный ответ, также, как и потенциал действия, обусловлен натриевой проницаемостью, которая, однако, недостаточна, чтобы вызвать быструю регенеративную деполяризацию, сопровождающуюся пиковой активностью. Локальный ответ перерастает в потенциал действия, если амплитуда его достигает уровня критической деполяризации. Это происходит при приближении силы стимула к пороговой величине. Потенциал действия, возникший в месте раздражения, способен к распространению вдоль нервного или мышечного волокна. В естественных условиях потенциалы действия генерируются в нервных волокнах при раздражении рецепторов и возбуждении нервных клеток. Потенциал действия, достигая окончания аксона, вызывает секрецию медиаторов в синапсах. В мышечных волокнах ПД инициирует мышечное сокращение. Ионы, проникающие в цитоплазму во время генерации потенциалов действия, оказывают регулирующее влияние на метаболизм клетки. Для регистрации ПД используются внеклеточные и внутриклеточные электроды. При внеклеточном отведении электроды подводят к наружной поверхности клетки. Это позволяет обнаружить, что поверхность возбужденного участка на очень короткое время (в нервном волокне на тысячную долю секунды) становится заряженной отрицательно по отношению к соседнему покоящемуся участку. Использование внутриклеточных микроэлектродов позволяет количественно охарактеризовать изменения МП во время восходящей и нисходящей фаз ПД. Следует отметить, что в литературе существует много различных названий фаз ПД: 1) местное возбуждение – пик ПД – следовые потенциалы; 2) фаза нарастания – фаза спада – следовые потенциалы; 3) деполяризация – овершут (перехлест, превышение, перелет) – реполяризация. По мнению некоторых авторов [10], наиболее корректны названия фаз ПД, в которых заложена общая идея, например изменение заряда клетки: 1) фаза деполяризации – процесс исчезновения заряда клетки до нуля; 2) фаза инверсии (лат. «inversion» – переворачивание) – изменение заряда клетки на противоположный, т. е. весь период ПД, когда внутри клетки заряд положительный, а снаружи отрицательный; 3)
А
В
На рис. 1.4 приведены примеры записи ПД в скелетном мышечном волокне лягушки и гигантском аксоне кальмара, зарегистрированные с помощью внутриклеточных электродов. Вслед за потенциалом действия возникают следовые потенциалы, или следовые явления.
1.3.1. Механизм возникновения потенциала действия Сдвиги в величине МП при возбуждении связаны с изменениями ионной проницаемости мембраны. Если в состоянии покоя проницаемость мембраны для ионов К+ выше, чем для ионов Nа+, то при действии раздражителя проницаемость для ионов Nа+ повышается и в конечном итоге становится в 20 раз выше проницаемости для ионов К+. В результате превышения потока ионов Na+ из внешнего раствора в цитоплазму, по сравнению с направленным наружу калиевым током, происходит перезарядка мембраны.
1
Следует отметить, что в генезе восходящей фазы ПД у ракообразных и в гладких мышцах позвоночных ведущую роль играют ионы Ca++. В клетках миокарда начальный подъем потенциала действия связан с повышением проницаемости мембраны для Na+, а плато ПД обусловлено повышением проницаемости для ионов Ca++ (рис. 1.6).
Рис. 1.6. Потенциал действия мышечного волокна миокарда
1.3.2. Роль ионных каналов в генерации потенциала действия Изменение проницаемости клеточной мембраны для ионов Na+ и К+ при возбуждении связано с активацией и инактивацией селективных, потенциалзависимых Na- и К-каналов. В некоторых клетках, в частности в кардиомиоцитах, в волокнах гладкой мышцы важную роль в возникновении ПД играют управляемые каналы для Са++. Процесс открывания и закрывания каналов носит вероятностный характер. Изменение мембранного потенциала лишь определяет среднее число открытых каналов. Ионные каналы образованы макромолекулами белков, пронизывающими липидный бислой мембраны. Данные о функциональной организации каналов строятся на исследованиях электрических явлений в мембранах и влиянии на каналы различных химических агентов, таких, как токсины, ферменты, лекарственные вещества. Для количественной оценки зависимости ионных проводимостей от величины генерируемого потенциала применяется "метод фиксации потенциала". Сущность метода заключается в насильственном поддержании мембранного потенциала на любом заданном уровне. С этой целью на мембрану подается ток, равный по величине, но обратный по знаку ионному току. Измеряя этот ток при различных потенциалах, выявляют зависимость потенциала от ионных проводимостей мембраны. Для того чтобы выделить необходимый компонент из общего ионного тока, используют специфические блокаторы тех или иных каналов. На рис. 1.7 показаны изменения натриевой (gNa) и калиевой (gK) проницаемости мембраны нервного волокна во время фиксированной деполяризации. Установлено, что восходящая фаза ПД связана с быстрым увеличением натриевой проводимости (gNa), которая за доли миллисекунд достигает максимума, а затем медленно снижается. Снижение и прекращение натриевого тока происходит на фоне еще не завершившегося ПД, т. е. время открытия Na+-каналов ограничено и их закрытие происходит вне зависимости от разности потенциалов на мембране. После окончания деполяризации способность натриевых каналов вновь открываться восстанавливается постепенно в течение десятков мс.
Рис. 1.7. Временной ход изменений натриевой (gNa) и калиевой (gK) проницаемости мембраны при деполяризации мембраны аксона на 56 мВ: а - сплошные линии показывают проницаемость при длительной деполяризации, а пунктирные - при реполяризации мембраны через 0,6 и 6,3 мс; б - зависимость пиковой величины натриевой (gNa) и стационарного уровня калиевой (gK) проницаемости от мембранного потенциала
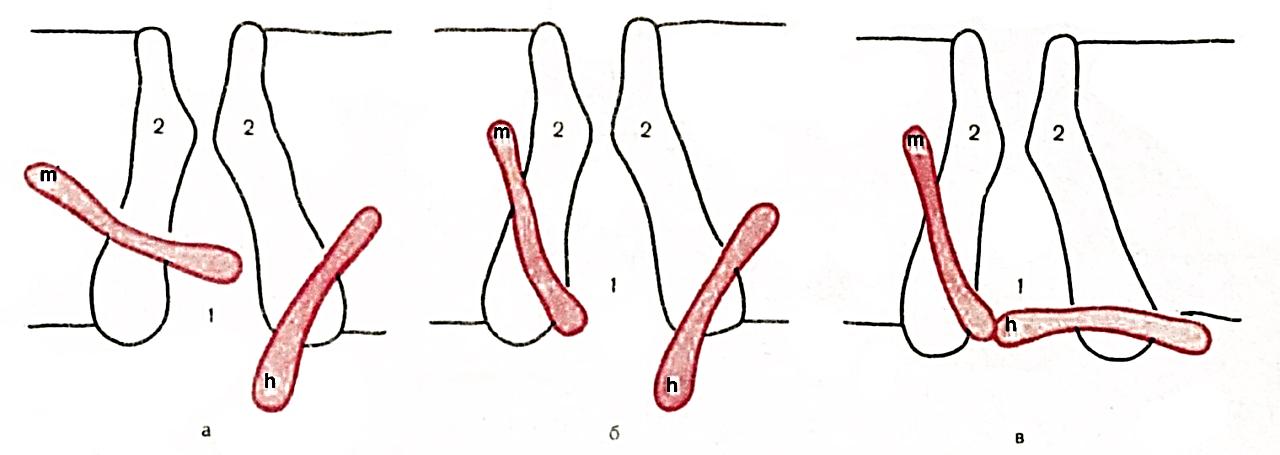
Приблизительно через 0,5–2 мс и более после начала деполяризации происходит увеличение проницаемости мембраны для ионов К+ (gK) и резкое возрастание выхода его из клетки. Для объяснения этих фактов была предложена гипотетическая модель существования у потенциал зависимых натриевых и калиевых каналов воротных механизмов, регулирующих проницаемость клеточной мембраны для Na+ и К+. В настоящее время доказана справедливость этой гипотезы, и функционирование потенциалзависимых натриевых и калиевых каналов в ходе генерации ПП можно представить следующим образом. Каналы для Na+ имеют наружное и внутреннее расширение ("устья") и короткий суженный участок (селективный фильтр) для отбора катионов по их размеру и свойствам. В области внутреннего конца натриевый канал снабжен двумя типами "ворот" – быстрыми активационными (m-"ворота") и медленными инактивационными (h-"ворота") (рис. 1.8).
а б в Рис. 1.8. Схематическое изображение электровозбудимого натриевого канала
Канал (1) образован макромолекулой белка (2). Активационные ворота (m) и инактивационные ворота (h). Потенциал покоя (а), деполяризация мембраны (б), продолжающаяся деполяризация (в). В условиях покоя активационные m-"ворота" закрыты, инактивационные h-"ворота" преимущественно (около 80 %) открыты; закрыты также калиевые активационные ворота (инактивационных ворот для К+ нет). Когда деполяризация клетки достигает критической величины (Екр, критический уровень деполяризации – КУД), которая обычно составляет –50 мВ, проницаемость мембраны для Na+ резко возрастает: открывается большое число потенциалзависимых m-"ворот" Na-каналов и Na+ лавиной устремляется в клетку. Через один открытый натриевый канал за 1 мс проходит до 6000 ионов. В результате интенсивного тока Na+ внутрь клетки деполяризация проходит очень быстро. Развивающаяся деполяризация клеточной мембраны вызывает дополнительное увеличение ее проницаемости и, естественно, проводимости Na+: открываются все новые и новые активационные m-"ворота" Na+-каналов, что придает току Na+ в клетку характер регенеративного процесса. В итоге ПП исчезает, становится равным нулю. Фаза деполяризации на этом заканчивается. Во вторую фазу ПД (фаза инверсии) происходит перезарядка мембраны: заряд внутри клетки становится положительным, снаружи – отрицательным. Активационные Фаза реполяризации связана с тем, что проницаемость клеточной мембраны для К+ все еще высока (активационные ворота калиевых каналов открыты). Ионы К+ продолжают быстро выходить из клетки по концентрационному градиенту, возвращая разность потенциалов на мембране к уровню ПП. В фазу реполяризации активационные m-"ворота" натриевых каналов закрываются, a h-"ворота" медленно открываются, канал возвращается в исходное состояние (рис. 1.9). Вслед за ПД, после полного восстановления исходного уровня ПП, в нервных и мышечных волокнах возникают сначала следовая гиперполяризацияя (положительный следовой потенциал), а затем следовая деполяризация (отрицательный следовой потенциал)[1]. Следовая гиперполяризация связана с сохраняющейся повышенной проницаемостью мембраны для К+, т. к. активационные ворота калиевых каналов еще не полностью закрыты. Следовая деполяризация, возможно, связана с кратковременным повышением проницаемости клеточной мембраны для Na+ и входом его в клетку по концентрационному и электрическому градиентам. Следовые явления в значительно большей мере, чем пики ПД, чувствительны к изменениям исходного ПП, ионного состава среды, кислородного снабжения волокна и т. д. Специфическим блокатором натриевых каналов является тетродотоксин – яд рыбы иглобрюха. Используя радиактивный тетродотоксин, подсчитали плотность натриевых каналов в мембране. У различных клеток она варьирует от десятков до десятков тысяч натриевых каналов на квадратный микрон мембраны. Селективность потенциалзависимых калиевых каналов выше селективности натриевых: они практически непроницаемы для Na+. Диаметр их селективного фильтра около 0,3 нм. Активация калиевых каналов характеризуется более медленной кинетикой, чем активация натриевых каналов. Блокаторами калиевых каналов являются органический катион – тетраэтиламмоний и аминопиридины.
Рис. 1.9. Состояние натриевых и калиевых каналов в различные фазы потенциала действия (объяснение в тексте)
Блокаторами кальциевых каналов, характеризующихся также медленной кинетикой процессов активации, являются некоторые органические соединения, как верапамил, нифедипин. Они используются в клинической практике для подавления повышенной электрической активности гладких мышц. Во время импульсной активности через каждый квадратный микрон мембраны гигантского аксона кальмара в протоплазму поступает 20 000 ионов Na+ и столько же ионов К+ покидает волокно. При возбуждении и повышении внутриклеточной концентрации ионов Na+ активируются Na+, К+-насос. Благодаря работе насоса, нарушенное при возбуждении неравенство ионных концентраций полностью восстанавливается. Скорость выведения Na+ из цитоплазмы активным ионным транспортом относительно мала, в 200 раз ниже скорости движения этих ионов через мембрану по концентрационному градиенту.
[1] Примечание. В некоторых учебниках замедление фазы реполяризации также называют отрицательным следовым потенциалом.
| ||||||||
|
| ||||||||
| Сайт создан по технологии «Конструктор сайтов e-Publish» | ||||||||