|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
1.2.Потенциал покояПотенциалом покоя (ПП) называют трансмембранную разность потенциалов, существующую между цитоплазмой и окружающим клетку наружным раствором в состоянии покоя. При этом внутренний потенциал отрицателен по отношению к наружному, условно принимаемому за нуль. Для измерения ПП, а также другой электрической активности возбудимой клетки применяют технику внутриклеточных микроэлектродов. Микроэлектрод представляет собой тонкий капилляр, вытянутый из стеклянной трубки, диаметр кончика которого составляет 0,5 мкм. В микротрубочку погружают хлорированную серебряную проволоку, служащую электродом, и заполняют солевым раствором (обычно 3М KC1) для обеспечения электрической проводимости. Микроэлектрод соединяют с электроизмерительным прибором – осциллографом, снабженным усилителем постоянного тока (рис. 1.1).
Рис. 1.1. Регистрация мембранного потенциала покоя возбудимой клетки и схема опыта его регистрации: 1 - клетка; 2 - микроэлектрод; 3 - регистратор
Пока кончик микроэлектрода находится в межклеточной среде, стрелка электроизмерительного прибора стоит на нуле. В момент прокола покоящейся мембраны клетки микроэлектродом луч осциллографа скачком отклоняется вниз до уровня ПП. Величина ПП у разных клеток варьирует от 50 до 90 мВ. Ниже приведены значения ПП для некоторых возбудимых образований: – гигантский аксон кальмара – 70 мВ; – гигантский аксон каракатицы – 60 мВ; – мышечное волокно лягушки – 88 мВ; – моторный нейрон кошки – 70 мВ.
1.2.1. Природа потенциала покоя
В 1896 г. В.Ю. Чаговец впервые высказал гипотезу об ионном механизме электрических потенциалов в живых клетках и сделал попытку объяснить их с позиции теории электролитической диссоциации С. Аррениуса. В 1902 г. Ю. Бернштейном была разработана мембранно-ионная теория, согласно которой потенциал покоя нервных и мышечных волокон определяется избирательной проницаемостью мембраны для ионов калия и их диффузией по концентрационному градиенту. В 1949–1952 гг. мембранно-ионную теорию модифицировали и экспериментально обосновали А. Ходжкин, А. Хаксли и др. Исследователям удалось найти замечательный объект – гигантский аксон кальмара диаметром 1 мм, иннервирующий мышцы мантии. В такой аксон можно было легко вводить микроэлектрод, заменять внутреннее содержимое волокна искусственными растворами. Опыты на гигантских аксонах кальмара показали, что концентрационный градиент K+, действительно, является основным фактором, определяющим величину потенциала покоя нервного волокна. Когда аксоплазму заменяли раствором K+, близким по концентрации внутриклеточной, то на мембране устанавливалась разность потенциалов, близкая к значению нормального потенциала покоя (–50…–80 мВ), и волокно проводило импульсы. При уменьшении внутриклеточной концентрации K+ потенциал покоя по абсолютной величине уменьшался, при увеличении концентрации K+ – увеличивался. На основании проведенных опытов была сформулирована современная мембранная теория, суть которой сводится к следующим основным положениям: - мембрана клетки любого возбудимого образования в покое поляризована. При этом ее внутренняя поверхность заряжена отрицательно, а наружная – положительно; - наличие электрических потенциалов в животных клетках обусловлено неравенством концентраций ионов Na+, K+, C1–, Ca++ внутри и вне клетки, а также их различной проницаемостью через мембрану; - в состоянии покоя внутри нервных и мышечных клеток концентрация K+ в 30–40 раз выше, чем в наружном растворе. Концентрация Na+ вне клетки в 10–12 раз больше, чем внутри. Вне клетки больше также и ионов C1–. Создание такого ионного баланса осуществляется особыми транспортными белками – насосами, обеспечивающими перенос ионов с затратой энергии вопреки концентрационному градиенту; - в покое мембрана нервных клеток наиболее проницаема для ионов K+, менее – для C1– и очень мало проницаема для ионов Na+ (в 100 раз меньше, чем для K+). Перемещение этих ионов в клетку и из клетки осуществляется преимущественно через неспецифические каналы ионной утечки; - для многих анионов органических кислот, присутствующих в цитоплазме, мембрана в покое непроницаема; - благодаря преимущественной проницаемости мембраны для ионов К+ в состоянии покоя, происходит их перемещение по концентрационному градиенту из клетки наружу; с выходом ионов К+ из клетки в цитоплазме накапливается отрицательный электрический заряд; - в силу возникающего мембранного потенциала ионы K+ по электрическому градиенту частично возвращаются обратно в клетку. Когда число выходящих из клетки ионов K+ становится равным числу входящих в клетку, то на мембране устанавливается так называемый равновесный калиевый потенциал, обозначаемый Ек (равновесный потенциал для любого иона можно рассчитать по формуле В. Нернста):
Мембранный потенциал покоя, определяемый для гигантского аксона кальмара, в эксперименте равен –70 мВ, т. е. менее отрицательный, чем рассчитанный по формуле Нернста калиевый равновесный потенциал (Ек = –90 мВ). Это несоответствие связано с диффузией ионов Na+ и C1– через поверхностную мембрану по концентрационному градиенту.
где Еion – потенциал, создаваемый данным ионом; R - газовая постоянная (8,31 Дж/моль K); T – абсолютная температура (273 +37 °C); Z – валентность иона; F – число Фарадея (9,65•104 Кл/моль); [ion] o – концентрация иона во внешней среде клетки (outside); [ion] i – концентрация иона внутри клетки (inside). Концентрация положительно заряженных ионов, находящихся снаружи, располагается в числителе формулы Нернста; концентрация ионов, находящихся внутри клетки, – в знаменателе. Для отрицательно заряженных ионов расположение противоположное. Равновесный натриевый потенциал (ЕNа) гигантского аксона кальмара при соотношении Nai/Nao = 69/425 мМ составляет +46 мВ. Поэтому диффузия положительно заряженных ионов натрия внутрь клетки уменьшает абсолютную величину внутреннего отрицательного потенциала, создаваемого диффузией K+. Влияние C1– на величину ПП противоположно влиянию Na+. В нервных волокнах проницаемость ионов C1– покоящейся мембраны относительно мала, и они не играют существенной роли в генезе ПП. В скелетных мышечных волокнах проницаемость для ионов C1– сопоставима с калиевой проницаемостью, и поэтому диффузия C1– увеличивает абсолютную величину потенциала покоя. Рассчитанный по формуле Нернста хлорный равновесный потенциал мышечного волокна лягушки при соотношении концентрации ионов C1i/ C10, равном 1/64 мМ, составляет –105 мВ (табл. 1).
Таблица 1. Содержание ионов K+, Na+, C1–, равновесные потенциалы, потенциалы покоя и действия некоторых клеток
В связи с имеющей место хлорной и натриевой проницаемостью Гольдманом–Ходжкиным–Катцом предложено уравнение для расчета мембранного потенциала покоя (Ем):
где величины РK; PNа; PC1 - проницаемость мембраны для соответствующих ионов. Было рассчитано, что при Eм = –50 мВ в изолированном гигантском аксоне кальмара имеет место следующее соотношение между ионными проницаемостями мембраны в покое: РK : РNа : РC1 = 1: 0,04: 0,45. Таким образом, потенциал покоя – это производное равновесных потенциалов всех ионов, находящихся внутри и вне клетки, величина которого определяется деятельностью Na+-, К+-насоса, а также следующими основными факторами: 1) соотношением концентраций катионов и анионов, проникающих через мембрану в состоянии покоя; 2) соотношением проницаемостей мембраны для этих ионов.
1.2.2. Роль ионных насосов в формировании потенциала покоя
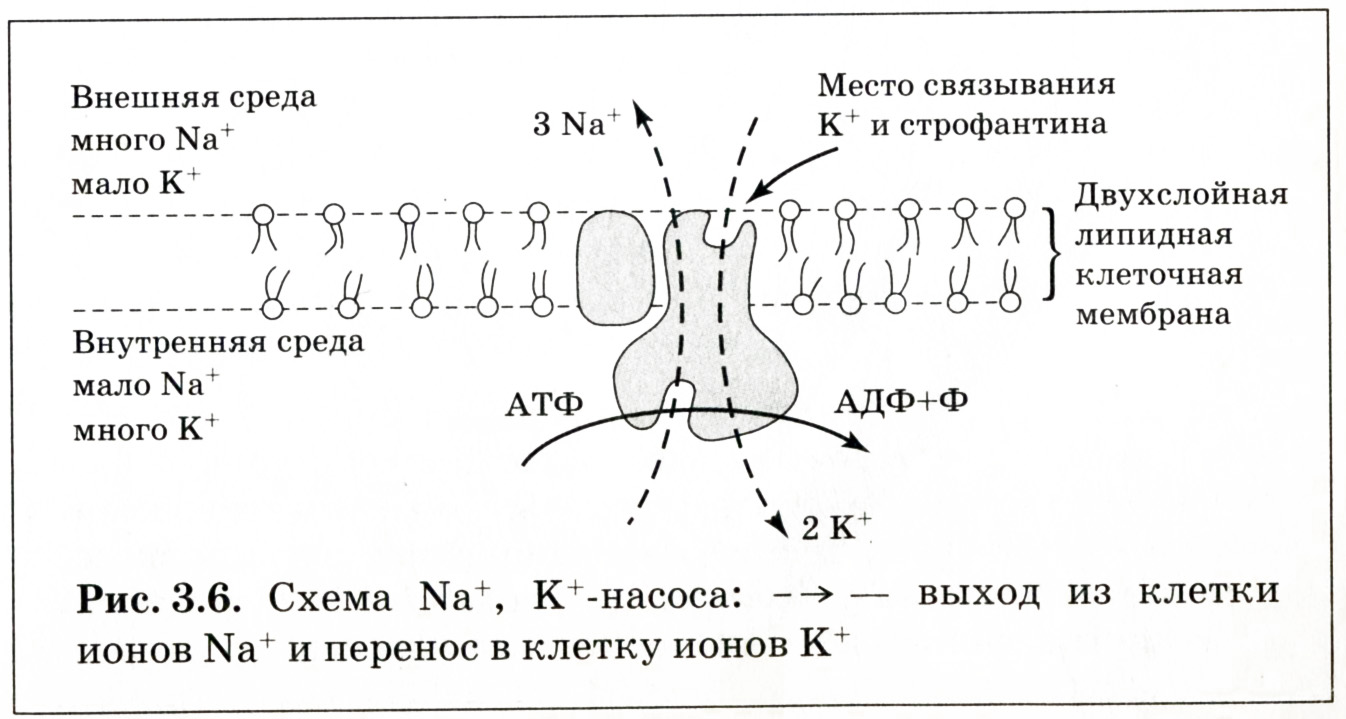
В результате постоянной диффузии Na+ и K+ через поверхностную мембрану их концентрации внутри и вне клетки, несмотря на малые потоки ионов, должны были бы в конечном итоге уравняться. Однако этого не происходит, поскольку на мембране работает активный механизм поддержания градиентов концентрации Na+ и K+ внутри и вне клетки. Поддержание трансмембранного градиента концентраций Na+ и K+ является важным условием для формирования ПП. Ионный насос, в частности натрий-калиевый, обладающий АТФазной активностью, обеспечивает выведение из клетки Na+ и введение в клетку K+ против их концентрационных градиентов. Натриевый насос – крупный белок (около 1000 аминокислот), встроенный в мембрану и имеющий на внутренней поверхности места связывания для Na+ и АТФ, а на наружной поверхности – для K+. Накопление Na+ в клетке стимулирует работу натрий-калиевого насоса, уменьшение Na+ в клетке снижает его активность, поскольку снижает вероятность контакта ионов с соответствующим переносчиком. Источником энергии для работы насосов является АТФ. Известно, что натрий-калиевый насос потребляет 1/3 расходуемой энергии в организме. За одну секунду один Na+, К+-насос переносит 150–600 ионов. Натрий-калиевый насос вносит вклад в величину ПП. Связано это с тем, что на каждые три иона Na+, выводимые насосом за один цикл работы из клетки, внутрь клетки нагнетается только два иона К+. Такой асимметричный перенос ионов Na+-, К+-насосом поддерживает избыток положительно заряженных частиц на наружной поверхности клеточной мембраны и отрицательных зарядов внутри, что позволяет считать насос электрогенной структурой. Натрий-калиевый насос дополнительно увеличивает ПП примерно на 5–10 мВ и создает разность потенциалов, суммирующуюся с потенциалом покоя. Вклад натриевого насоса в величину потенциала покоя у различных клеток неодинаков. В нервных волокнах кальмара он незначителен, а в гигантских нейронах моллюсков, гладких мышцах составляет около 25 % от полной величины потенциала покоя.
Рис. 1.2. Схема Na+-, К+-насоса: ® - выход из клетки ионов Na+ и перенос в клетку ионов К+
Нарушение работы насоса при патологии и в эксперименте, при действии некоторых химических соединений, например сердечного гликозида – уабаина, а также ингибиторов дыхательных ферментов – цианидов, сопровождается потерей клеткой ионов калия и обогащением ее ионами натрия. Специфическим блокатором деятельности натрий-калиевого насоса является токсин растительного происхождения строфантин, присоединяющийся к месту связывания К+ (рис. 1.2). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сайт создан по технологии «Конструктор сайтов e-Publish» | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||