Тема
1. Предмет и методы гистологии
План:
2. Понятие о ткани
и ее структурные компоненты.
3. Методы исследования в гистологии.
4. Принципы приготовления гистологического препарата.
1.
Предмет гистологии
Гистология (от греч. histos - ткань, logos - учение) – наука о строении, развитии и жизнедеятельности тканей животных организмов. Курс гистологии связан с другими биологическими дисциплинами: цитологией, эмбриологией, анатомией, физиологией, биохимией, патологической анатомией. Знания гистологии необходимы для закладывания основ научного структурно-функционального подхода в анализе жизнедеятельности организма человека и животных в норме и при патологии.
К ее фундаментальным теоретическим
проблемам относятся:
- изучение
закономерностей цито- и гистогенеза, строения и
функции клеток и тканей;
- изучение
закономерностей дифференцировки и регенерации тканей;
- выяснение роли
нервной, эндокринной, иммунной систем организма в регуляции процессов
морфогенеза клеток, тканей и органов и их функционирования;
- исследование
возрастных изменений клеток, тканей, органов;
- исследование
адаптации клеток, тканей и органов к действию различных биологических,
физических, химических и других факторов;
- изучение процессов
морфогенеза в системе мать - плод;
- исследование особенностей
эмбриогенеза человека.
Актуальными прикладными проблемами являются
исследование клеточной и тканевой совместимости при переливании крови,
трансплантации тканей, при действии стрессовых факторов, изучение
регенерационных возможностей тканей в различных условиях, разработка
морфологических тестов для оценки возрастных изменений, цитодиагностики и др.
2. Понятие о ткани и ее структурные
компоненты
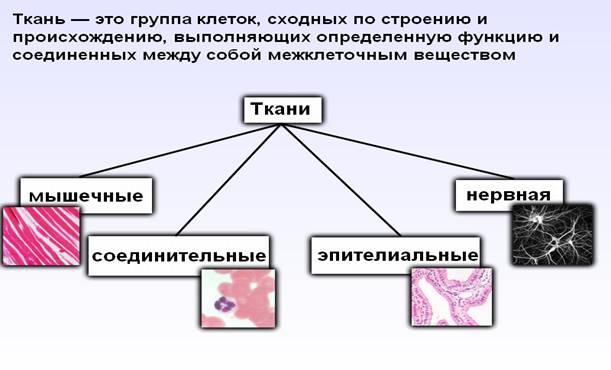
Ткань – исторически (филогенетически)
сложившаяся система клеток и межклеточных структур, обладающая общностью
строения, происхождения и специализированная на выполнении определенных функций
(рис. 1). Ткани служат элементами
развития, строения и жизнедеятельности органов и их систем. В организме
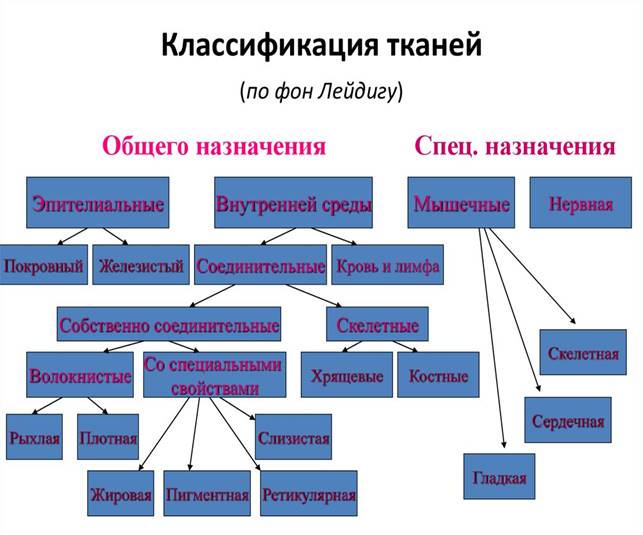
животных и человека выделяют 4 типа тканей: эпителиальную, соединительную,
мышечную, нервную.
Каждая ткань образована клеточными элементами и
межклеточным веществом или тканевым матриксом.
1.
Клетки
– основные, функционально ведущие компоненты тканей. Практически все ткани
состоят из нескольких типов клеток. Клетки каждого типа в тканях могут
находиться на разных этапах зрелости (дифференцировки). Поэтому в ткани
различают такие понятия, как клеточная популяция и клеточный
дифферон.
Клеточная
популяция – это совокупность клеток данного типа. Например, в крови содержится:
1) популяция эритроцитов;
2) популяция лейкоцитов;
3) популяция тромбоцитов.
Клеточный
дифферон (или гистогенетический ряд) – это клети
одного типа, находящихся на различных этапах дифференцировки. Исходными клетками дифферона
являются стволовые клетки, далее идут молодые (бластные)
клетки, созревающие клетки и зрелые клетки.
2.
Симпласты – слияние отдельных клеток в единое под
общей плазмолеммой, например скелетное мышечное волокно.
3. Синцитий – несколько клеток, соединенных между собой отростками, например сперматогенный эпителий извитых ка нальцев семенника.
4.
Постклеточные образования – утратившие
многие органоиды клетки (эритроциты) или фрагменты клеток (тромбоциты).
Межклеточное вещество – также продукт деятельности тканеобразующих клеток, оно неодинаково выражено у разных тканей и состоит из:
1) аморфного или основного
вещества;
2) волокон (коллагеновых,
ретикулярных, эластических); они присутствуют в соединительных тканях.
3. Методы
исследования в гистологии
Биологические объекты можно изучать на тканевом, клеточном, субклеточном и молекулярном уровнях.
Выделяются
следующие методы гистологии:
1. Микроскопия.
Различают
следующие виды микроскопии (рис. 2):
1) световая микроскопия (наиболее распространенный вид микроскопии, при этом разрешающая способность микроскопа составляет 0,2 мкм), увеличение в 1500–2500 раз (рис. 2, А).
2)
ультрафиолетовая
микроскопия (разрешающая способность микроскопа составляет 0,1 мкм);
3)
люминесцентная
микроскопия (применяется для определения в исследуемом гистологическом
препарате определенных химических структур);
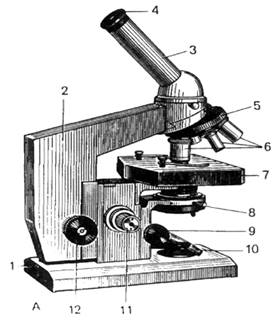
Рис. 2. Микроскопы для биологических
исследований.
А – световой биологический микроскоп "Биолам-С": 1 - основание; 2 - тубусодержатель;
3 - наклонный тубус; 4 - окуляр; 5 - револьвер; 6 - объективы; 7 - столик; 8 -
конденсор с ирисовой диафрагмой; 9 - винт конденсора; 10 - зеркало; 11 -
микрометрический винт; 12 - макрометрический винт. Б – электронный
микроскоп ЭМВ-100АК с автоматизированной системой обработки изображений: 1 -
колонка микроскопа (с электронно-оптической системой и камерой для образцов); 2
- пульт управления; 3 - камера с люминесцентным экраном; 4 - блок анализа
изображений; 5 - датчик видеосигнала.
4)
фазово-контрастная
микроскопия (применяется для обнаружения и изучения определенных структур в
неокрашенных гистологических препаратах);
5)
поляризационная
микроскопия (используется в основном для изучения волокнистых структур);
6)
микроскопия
в темном поле применяется для изучения живых объектов;
7)
микроскопия
в падающем свете (предназначена для изучения толстых объектов);
8) электронная микроскопия (наиболее
современный вид микроскопии, имеющий разрешающую способность 0,1–0,7 нм) (рис. 2, Б).
В электронном микроскопе
используется поток электронов с более короткими, чем в световом микроскопе,
длинами волн, разрешаемое расстояние составляет около 0,1–0,7 нм. Главными
достоинствами растровой электронной микроскопии являются большая глубина резкости,
широкий диапазон непрерывного изменения увеличения (от десятков до десятков
тысяч раз) и высокая разрешающая способность. Имеются
две разновидности электронной микроскопии –
просвечивающая (трансмиссионная) и сканирующая (или растворная) микроскопия,
дающая отображение поверхностных ультраструктур.
2. Гистологические
и цитохимические методы
применяются для определения состава химических веществ и их количества в
определенных структурах. Принцип метода заключается в химической реакции между
реактивом и субстратом, содержащимся в исследуемом веществе. При этом
образующиеся побочные продукты реакции можно обнаружить с помощью световой или
люминесцентной микроскопии.
3. Метод гистоавторадиографии позволяет выявить состав химических
веществ в исследуемых структурах и интенсивность обмена по включению
радиоактивных изотопов. Данный метод чаще всего используется при экспериментах
на животных.
4. Метод интерферонометрии позволяет определять сухую массу вещества
в живых или фиксированных объектах.
5.
Метод культуры клеток –
это выращивание клеток в пробирках с питательной средой или в особых капсулах в
организме и последующее изучение живых клеток под микроскопом. Метод культивирования клеток
позволяет изучать их жизнедеятельность, размножение, дифференцировку,
взаимодействие с другими клетками, влияние гормонов, факторов роста и др.
6. Метод витального окрашивания – введение животным в кровь или в брюшную
полость красителя (трепанового синего), который при
жизни животного захватывается определенными клетками – макрофагами, а после
забоя животного и приготовления препарата определяются и подсчитываются клетки,
содержащие краситель.
7. Иммуноморфологические методы позволяют с помощью предварительно
проведенных иммунных реакций (на основе взаимодействия антиген – антитело)
определять субпопуляцию лимфоцитов, степень
чужеродности клеток, проводить гистологическое типирование тканей и органов, т.
е. определять их гистосовместимость для дальнейшей
трансплантации.
8. Метод дифференциального
центрифугирования – изучение
отдельных органелл или даже их фрагментов, выделенных из клетки. Для этого
кусочек исследуемого органа растирают, заливают физиологическим раствором, а
затем разгоняют в центрифуге при различных оборотах (от 2 до 150 тыс. в 1 мин).
В результате центрифугирования получают интересующие фракции, которые затем
изучают различными методами.
9. Методы морфометрии – количественные методы. Они позволяют
определять размеры и объемы ядра – кариометрия,
клеток – цитометрия, органелл – электронная
морфометрия, а также определять число клеток различных популяций и субпопуляций. Данные методы широко используются в научных
исследованиях.
10. Эспериментальные
методы – пищевая и водная
нагрузка, физические методы (УВЧ, СВЧ, лазеры, магниты). Они применяются для
изучения реакции интересующих структур на то или иное воздействие и сочетаются
с методами морфометрии, цито и гистохимии.
Таким образом, основным
методом исследования в гистологии является микроскопирование
– изучение гистологических препаратов под микроскопом. Применение новых
методов исследований в гистологии позволяет выяснить общие закономерности
организации тканей и клеток, структурные основы биохимических процессов,
определяющих функцию конкретных структурных компонентов клетки.
4. Принципы
приготовления гистологического препарата
Объектами исследования служат живые и фиксированные клетки и ткани, их
изображения, полученные в световых и электронных микроскопах или на
телевизионном экране дисплея. Из тканей изготавливаются гистологические
препараты. Препарат может представлять собой мазок
(например, мазок крови, костного мозга, слюны, цереброспинальной
жидкости и др.), отпечаток (например, селезенки, тимуса,
печени), пленку из ткани (например, соединительной или брюшины,
плевры, мягкой мозговой оболочки), тонкий срез. Наиболее часто для
изучения используется срез ткани или органа. Гистологические препараты могут
изучаться без специальной обработки, сразу рассматриваться под микроскопом. Но
вследствие того, что структуры имеют слабый контраст, они плохо выявляются в
обычном световом микроскопе, поэтому чаще применяют специально обработанные и
окрашенные препараты.
Процесс изготовления гистологического препарата для
световой и электронной микроскопии включает следующие основные этапы: 1) взятие
материала и его фиксация, 2) уплотнение материала, 3) приготовление срезов, 4)
окрашивание срезов. Для световой микроскопии необходим еще один этап – заключение срезов в бальзам или другие
прозрачные среды.
Фиксация обеспечивает предотвращение процессов разложения, что
способствует сохранению целостности структур. Это достигается
тем, что взятый из органа маленький образец либо погружают в фиксатор (спирт,
формалин, растворы солей тяжелых металлов, осмиевая кислота, специальные
фиксирующие смеси), либо подвергают термической обработке, вследствие которого
жизнедеятельность прекращается, а структуры становятся мертвыми,
фиксированными. Фиксация приводит к уплотнению и уменьшению объема
кусочков, а также к улучшению последующей окраски клеток и тканей.
Уплотнение кусочков, необходимое
для приготовления срезов, производится путем пропитывания предварительно
обезвоженного материала парафином, целлоидином, органическими смолами. Более
быстрое уплотнение достигается применением метода замораживания кусочков,
например в жидкой углекислоте.
Приготовление срезов производится на специальных приборах – микротомах
(для световой микроскопии) и ультрамикротомах (для электронной
микроскопии).
Окрашивание
срезов (в световой
микроскопии) или напыление их солями
металлов (в электронной микроскопии) применяют для
увеличения контрастности изображения отдельных структур при рассматривании их в
микроскопе. Методы окраски гистологических структур очень разнообразны и
выбираются в зависимости от задач исследования.
Наиболее широко применяются основные красители (гематоксилин) и
кислые (эозин). Часто используются и сложные красители.
Избирательное сродство структур к определенным красителям обусловлено их
химическим составом и физическими свойствами.
Для длительного сохранения
обезвоженный гистологический срез заключают между
предметным и покровным стеклами в канадский бальзам или другие вещества.
Готовый гистологический препарат может быть использован для изучения под
микроскопом в течение многих лет.
Для электронной микроскопии срезы, полученные на ультрамикротоме, используют только 1 раз, помещают на специальные сетки, контрастируют солями марганца, кобальта и др., после чего просматривают в микроскопе и фотографируют и изучение структур ткани производится по электронограмме