Лекция 7: Предельные углеводороды
План лекции:
1.
Общая
классификация, гомологический ряд
2.
Номенклатура
и изомерия
3.
Химические
свойства
1. Общая классификация, гомологический ряд
Углеводороды — это
органические соединения, состоящие из атомов углерода и водорода, классифицирующиеся следующим образом:

Предельные
углеводороды (алканы, насыщенные углеводороды,
парафины, алифатические соединения) – это углеводороды линейного или
разветвленного строения, содержащие только простые (одинарные) связи. Предельными
углеводородами являются алканы, образующие
гомологический ряд с общей формулой CnH2n+2. Простейшим представителем класса является метан (CH4).
|
Гомологический
ряд алканов (первые 10 членов) |
||
|
Метан |
CH4 |
CH4 |
|
Этан |
CH3—CH3 |
C2H6 |
|
Пропан |
CH3—CH2—CH3 |
C3H8 |
|
Бутан |
CH3—CH2—CH2—CH3 |
C4H10 |
|
Пентан |
CH3—CH2—CH2—CH2—CH3 |
C5H12 |
|
Гексан |
CH3—CH2—CH2—CH2—CH2—CH3 |
C6H14 |
|
Гептан |
CH3—CH2—CH2—CH2—CH2—CH2—CH3 |
C7H16 |
|
Октан |
CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH3 |
C8H18 |
|
Нонан |
CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 |
C9H20 |
2. Номенклатура и изомерия
Названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему
корню от названия углеводорода. По номенклатуре основой для названия
служит одна углеродная цепь, а все другие фрагменты молекулы рассматриваются
как заместители. В этом случае выбирают наиболее длинную цепь углеродных атомов
и атомы цепи нумеруют с того конца, к которому ближе стоит углеводородный
радикал. Затем называют: 1) номер углеродного атома, с которым связан радикал
(начиная с простейшего радикала); 2) углеводород, которому соответствует
длинная цепь. Если в формуле содержится несколько одинаковых радикалов, то
перед их названием указывают число прописью (ди-, три-, тетра- и т. д.), а номера радикалов разделяют запятыми.
Вот как по этой номенклатуре следует назвать изомеры гексана:
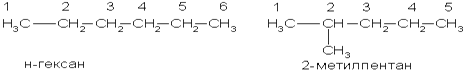
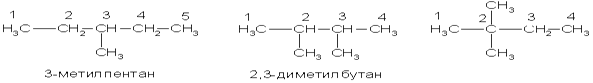
3. Химические свойства
Алканы имеют низкую химическую активность. Это
объясняется тем, что единичные C-H и C-C связи относительно прочны и их сложно разрушить. Поскольку углеродные связи неполярны,
а связи С — Н малополярны,
оба вида связей малополяризуемы, их разрыв наиболее
вероятен по гомолитическому механизму то есть с
образованием радикалов.
3.1. Реакции радикального замещения
а) галогенирование алканов протекает по радикальному
механизму. Для инициирования реакции необходимо смесь алкана
и галогена облучить УФ-светом или нагреть.
Хлорирование метана не останавливается на стадии получения метилхлорида
(если взяты эквимолярные количества хлора и метана),
а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода.
Хлорирование других алканов приводит к смеси продуктов замещения
водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит
от температуры, а галогенирование
происходит тем легче, чем длиннее углеродная цепь н-алкана. Галогенирование — это одна из реакций
замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем
вторичный, первичные атомы галогенируются в последнюю
очередь). Галогенирование алканов проходит
поэтапно — за один этап замещается не более одного атома водорода:
1. CH4 + Cl2 →
CH3Cl + HCl (хлорметан)
2. CH3Cl + Cl2 →
CH2Cl2 + HCl (дихлорметан)
3. CH2Cl2 +
Cl2 → CHCl3 + HCl
(трихлорметан)
4. CHCl3 + Cl2 →
CCl4 + HCl (тетрахлорметан).
б) нитрование – замещение
атома водорода нитрогруппой – NO2 c образованием нитроалканов; нитрующий реагент
азотная кислота HNO3. Алканы реагируют с
10 % раствором азотной кислоты или оксидом азота NO2 в газовой
фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных.
СH4
+ HО-NO2
→ СН3NO2 + H2O.
метан
азотная нитрометан
кислота
Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции
образуются смеси продуктов.
в) сульфирование (замещение атомов водорода сульфогруппой
-SO3Н с образованием алкансульфокислот RSO3Н).
Сульфирующий реагент – серная кислота Н2SO4 (НО─SO3Н).
Сульфирование алканов происходит при действии очень концентрированной Н2SO4 при
небольшом нагревании. Наиболее легко замещается атом водорода у третичного
атома углерода:
3.2. Реакции
окисления
а) окисление
кислородом воздуха при высоких температурах (горение)
Основным химическим свойством предельных
углеводородов, определяющих их использование в качестве топлива, является
реакция горения. Пример:
CH4 + 2O2 →
CO2 + 2H2O
В случае нехватки кислорода вместо
углекислого газа получается угарный газ или уголь (в зависимости от
концентрации кислорода).
2CH4 + 3O2 →
2CO + 4H2O
б) окисление
кислородом воздуха при невысоких температурах в присутствии
катализаторов. В результате могут образоваться альдегиды, кетоны, спирты,
карбоновые кислоты.
3.3. Термические
превращения алканов
а) разложение происходит лишь под влиянием больших температур, что приводит
к разрыву углеродной связи и образованию свободных радикалов.
CH4 →
C + 2H2 (t > 1000 °C)
C2H6 →
2C + 3H2
СН3 – СН2 – СН2 – СН3 → СН3 – СН3 + СН2
= СН2
СН3 – СН2 – СН2 – СН3 → СН4
+
СН2 = СН2– СН3
б) дегидрирование –
отщепление
водорода; происходит в результате разрыва связей С
─ Н; осуществляется в присутствии катализатора при повышенных
температурах с образованием алкена:
в) дегидроциклизация (ароматизация) - реакция дегидрирования, которая
приводит к замыканию цепи в устойчивый цикл. Алканы с
шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:





