РАЗДЕЛ 2. ЭЛЕКТРОННЫЕ СВОЙСТВА БИОПОЛИМЕРОВ
2.1. ЭЛЕКТРОННЫЕ
УРОВНИ В БИОПОЛИМЕРАХ
Спектроскопические
методы исследования в молекулярной биофизике играют центральную роль. Спектральные
свойства молекул определяются набором энергетических уровней, характерным для
данного соединения. Изменение конформации молекулы биополимера
или взаимодействие её с другими молекулами (водой, гормонами, субстратами и
т.д.) влияют на положение энергетических уровней, а, следовательно, и на спектральные
характеристики макромолекулы.
Важную информацию о
структуре молекул биополимеров получают исследуя их спектры.поглощения. Спектр поглощения есть график
зависимости коэффициента поглощения от длины волны падающего света. Спектр
поглощения в конденсированной фазе характеризуется набором полос поглощения,
положение которых, ширина и высота определяются расстоянием между
энергетическими уровнями и колебательной структурой этих уровней.
Макромолекулы
содержат различные хромофорные группировки, ответственные за поглощение света в
той или иной области спектра.
Состояние
электрона в атоме описывается волновой функцией ![]() .
Физический смысл волновой функции состоит в том, что квадрат волновой функции
пропорционален вероятности
(
.
Физический смысл волновой функции состоит в том, что квадрат волновой функции
пропорционален вероятности
(![]() ) того, что электрон находится в объеме
) того, что электрон находится в объеме ![]() ,
то есть
,
то есть ![]()
![]() .
.
Различным
состояниям электрона соответствуют разные волновые функции и, соответственно,
разные распределения вероятности нахождения электрона в пространстве. Волновые
функции электронов в атомах и молекулах называются орбиталями.
Сферически
симметричные орбитали атомов (![]() -орбитали) при образовании химических связей преобразуются в
симметричные относительно вращения вокруг оси, проходящей через соединяемые
атомы,
-орбитали) при образовании химических связей преобразуются в
симметричные относительно вращения вокруг оси, проходящей через соединяемые
атомы, ![]() -орбитали.
-орбитали.
![]() -орбитали атомов при образовании химической связи между ними
преобразуются в
-орбитали атомов при образовании химической связи между ними
преобразуются в ![]() - орбитали, обладающие симметрией относительно операции
инверсии (отражение со смещением).
- орбитали, обладающие симметрией относительно операции
инверсии (отражение со смещением). ![]() -орбитали могут образовывать и
-орбитали могут образовывать и ![]() -связи
при соответствующей ориентации атомов друг относительно друга.
-связи
при соответствующей ориентации атомов друг относительно друга.
Электронная орбиталь может быть локализованной. Это значит, что
плотность вероятности нахождения электрона вблизи определенного атома имеет максимум.
Например, электроны атомов кислорода, не участвующие в образовании химических
связей, локализованы вблизи этих атомов. Орбитали, заселяемые такими электронами, называются n-орбиталями.
П-электроны
обычно делокализованы.Это
значит, что ![]() орбиталь охватывает несколько атомов. Например, в молекуле
хлорофилла
орбиталь охватывает несколько атомов. Например, в молекуле
хлорофилла ![]() электроны
сопряженных двойных связей пиррольных радикалов делокализованы ("размазаны") по всему тетрапиррольному кольцу. Степень делокализации
может быть различной. Все типы орбиталей имеют
основное и возбужденное состояния, переходы между которыми могут быть индуцированы
квантами света.
электроны
сопряженных двойных связей пиррольных радикалов делокализованы ("размазаны") по всему тетрапиррольному кольцу. Степень делокализации
может быть различной. Все типы орбиталей имеют
основное и возбужденное состояния, переходы между которыми могут быть индуцированы
квантами света.
Спектральные
свойства хромофоров зависят от того между какими орбиталями происходят переходы при поглощении или испускании
света. Спектры поглощения белков имеют специфическую полосу поглощения с
максимумом при 280 нм. Эта полоса обусловлена наличием в белках ароматических
радикалов, принадлежащих остаткам тирозина, фенилаланина
и триптофана.
Амидная группировка
пептидной связи в белках ответственна за интенсивное поглощение при 190 нм. Эта
полоса поглощения соответствует П ![]() П* переходам (
П* переходам (![]() электроны
делокализованы по атомам азота, кислорода и
углерода).
электроны
делокализованы по атомам азота, кислорода и
углерода).
В области 210 - 220
нм имеется слабое поглощение, соответствующее n ![]() П* переходу (n-электрон локализован на атоме кислорода пептидной
группы).
П* переходу (n-электрон локализован на атоме кислорода пептидной
группы).
Электронные
переходы при поглощении света характеризуются дипольными моментами перехода.
При взаимодействии электромагнитной волны с молекулой происходит смещение элетронной плотности, в результате чего дипольный момент молекулы
изменяется. Свойства молекул таковы, что электрическое поле световой волны
должно действовать в определенном направлении, чтобы вызвать переход электрона
с одной орбитали на другую. Используя поляризованный
свет можно определить направление дипольного момента перехода в системе
координат, связанной с молекулой. А это позволяет определять ориентацию поглощающих
свет молекул (таких, например, как хлорофилл) в надмолекулярных структурах (например, в мембранах).
Спектры
поглощения нуклеиновых кислот имеют максимум при 260 нм, обусловленный
азотистыми основаниями нуклеотидов. Это поглощение связано с П ![]() П* переходами,
происходящими в плоскости ароматических колец азотистых оснований. Согласно
закону Бугера-Ламберта-Бера поглощение света описывается
формулой:
П* переходами,
происходящими в плоскости ароматических колец азотистых оснований. Согласно
закону Бугера-Ламберта-Бера поглощение света описывается
формулой:
![]() (3)
(3)
где I0 - интенсивность падающего света
I - интенсивность
света, прошедшего через слой поглощающее
го свет вещества
![]() - коэффициент
экстинкции
- коэффициент
экстинкции
c - поглощающего вещества
![]() - длина оптического пути (толщина поглощающего
слоя)
- длина оптического пути (толщина поглощающего
слоя)
Величина
![]() (4)
(4)
называется оптической плотностью.
Она пропорциональна концентрации поглощающего вещества и поэтому часто используется
при определении концентрации. Измерение оптической плотности позволяет определить
и толщину поглощающего слоя.
При переходе
спираль ![]() клубок в ДНК интенсивность поглощения света
при 260 нм увеличивается (до 30%). Это явление получило название гиперхромного эффекта. Уменьшение коэффициента поглощения называется
гипохромным эффектом.
клубок в ДНК интенсивность поглощения света
при 260 нм увеличивается (до 30%). Это явление получило название гиперхромного эффекта. Уменьшение коэффициента поглощения называется
гипохромным эффектом.
Физической причиной
гиперхромного эффекта является изменение окружения
хромофорной группировки. В двойной спирали азотистые основания расположены друг
над другом стопкой (стэкинг) и взаимодействуют друг с
другом. Это взаимодействие влияет на интенсивность поглощения света азотистыми
основаниями (интенсивность поглощения уменьшается по сравнению с
невзаимодействующими основаниями). В состоянии клубка стэкинг
- взаимодействия нет, и азотистые основания поглощают свет уже независимо друг
от друга.
Гиперхромный и гипохромный эффекты наблюдаются также в белках при конформационных переходах. Ароматические радикалы в
состоянии глобулы взаимодействуют с другими радикалами в гидрофобном ядре
молекулы. При переходе в состояние статистического клубка это взаимодействие нарушается и интенсивность поглощения света возрастает.
Таким
образом, по интенсивности поглощения света на определенных длинах волн можно
судить о конформации молекулы биополимера.
Весьма ценную
информацию о внутримолекулярных процессах можно получить
измеряя люминесценцию молекул. Люминесценция - это высвечивание молекулами
квантов света при возвращении электрона с возбужденного энергетического уровня
на основной.
Различные процессы
преобразования энергии в молекулах могут быть представлены на схеме, которая
содержит набор энергетических уровней и связей между ними.
Основные процессы могут быть отражены на схеме
Яблонского (рис.1). Имеется три главных энергетических уровня – S0, S1, и Т. S0 – это
основное синглетное состояние молекулы. Суммарный
спин молекулы в этом состоянии равен нулю. Поэтому Е
магнитном поле молекула будет иметь один энергетический уровень (отсюда
название "синглетный").
---------------- S1
--------------- Т
---------------- S0
Рис.1 Простейшая схема
энергетических уровней в молекуле
S1- это возбужденное синглетное состояние. Один из электронов, находящихся на уровне S0 может поглотить квант энергии равный расстоянию между уровнями и S0 и
S1,
в результате чего он перейдет на уровень S1.
Время
жизни на уровне S1 составляет 10-12 –10-8сек.
Через указанный промежуток времени электрон вернётся на уровень S0, а избыток энергии может быть либо высвечен в виде кванта света (этот
процесс называется флуоресценцией), либо растрачен в тепло.
Возможен и другой
процесс. Если за время жизни возбуждённого состояния в результате
взаимодействия электрона с колебаниями решётки произойдёт переворот
электронного спина, то суммарный спин молекулы станет равным единиц. При этом
часть энергии диссипирует в тепло. Это означает, что
электрон с синглетного уровня перешел на триплетный
уровень Т. Молекула в триплетном состоянии, будучи помещена в магнитное поле,
имеет три энергетических уровня, соответствующих трем ориентациям спина
молекулы относительно направления внешнего магнитного поля - по полю, против
поля и перпендикулярно полю.
Время
жизни триплетного состояния значительно превышает времена жизни синглетных состояний. Оно лежит широком диапазоне
от 10-6 сек до минут.
Возбужденные состояния молекул обладают повышенной
реакционной способностью. Поэтому многие реакции идут с ощутимой скоростью
только, если хотя бы один из участников реакции находится в возбужденном
состоянии.
Молекулы
биополимеров содержат десятки хромофорных групп. Поглощение кванта света
отдельной группировкой приводит к тому, что реакционная способность
увеличивается локально, именно в том место, где локализована эта хромофорная
группировка. Возможен, однако, и другой исход, когда поглощает свет одна
группировка, но энергия переносится на другую и уже эта группировка вступает в
химическую реакцию или высвечивает квант (сенсибилизированная люминесценция).
2.2. МИГРАЦИЯ
ЭНЕРГИИ
Энергия
поглощенного кванта света может быть перенесена от одной молекулы к другой или
от одной группировки к другой внутри молекулы без излучения кванта света. Под
миграцией энергии понимают именно безызлучательный
перенос энергии между сближенными в пространстве хромофорами. Схематически этот процесс можно изобразить
так:
![]()
где D - донор энергии
А - акцептор энергии
* - знак возбужденного
состояния
Существует
несколько физических механизмов миграции энергии.
Индуктивно-резонансный
механизм состоит в том, что молекула донора энергии, находясь на нижнем колебательном
подуровне возбуждённого состояния, индуцирует в молекуле акцептора энергии
колебания, соответствующие одному из верхних колебательных подуровней
возбужденного состояния акцептора. При этом энергия от донора передаётся акцептору.
Затем молекула акцептора переходит на нижний колебательный подуровень
возбужденного состояния, и обратный перенос энергии на молекулу донора
становится маловероятным.
Вероятность
миграции энергии по этому механизма обратнопропорциональна шестой степени расстояния между
молекулами донора и акцептора. Этот механизм эффективен на расстояниях 3-10 нм.
Чем больше перекрываются спектр флуоресценции донора и спектр поглощения
акцептора, тем больше вероятность миграции энергии по этому механизму.
По индуктивно-резонансному
механизму мигрирует энергия между ароматическими остатками в белках.
Флуоресценция белков обусловлена, главным образом, остатками триптофана, так
как энергия с тирозина и фенилаланина мигрирует на
остатки триптофана. Индуктивно-резонансный механизм миграции энергии тлеет
место при фотосинтезе между молекулами хлорофилла, образующими антенну.
Обменно-резонансный
механизм миграции энергии обусловлен перекрытием электронных волновых функций
донора и акцептора. Чем больше это перекрьгвание, тем
больше вероятность миграции энергии по данному механизму. Обменно-резонансный
механизм миграции эффективен на расстояниях 0.I - 0.3 нм между донором и акцептором. По обменно - резонансному
механизму происходит миграция с синглетного возбужденного
уровня хлорофилла на триплетный уровень каротиноидов.
В
молекулярных кристаллах миграция энергии может происходить по экситонному механизму. Экситон - это связанные
электрон и дырка. Эта квазичастица электрически нейтральна. Диффузия экситона
по молекулярному кристаллу означает перенос энергии от одного узла решётки к
другому.
Экситонные уровни расположены чуть ниже дна зоны проводимости в полупроводниках.
Столкновение зкситона с фононом может привести к
распаду его на электрон и дырку, которые могут выступать
в химических реакциях как восстановитель и окислитель соответственно. Распад
экситона может происходить на дефектах кристаллической решётки и примесных центрах.
Участие экситонного механизма миграции энергии предполагалось в
первичных стадиях фотосинтеза. В зависимости от электронной структуры молекул,
их взаимного расположения, фазового состояния может доминировать тот или иной
механизм миграции энергии. Соответственно и зависимость миграции энергии от
температуры, диэлектрической проницаемости, расстояния между молекулами и
других физических параметров определяется этими обстоятельствами. Миграция
энергии играет важную роль в фотобиологических процессах - фотосинтезе, фото динамическом эффекте и других.
2.3. ПЕРЕНОС
ЭЛЕКТРОНОВ В БИОСТРУКТУРАХ
Многие важные для
функционирования клетки механизмы связаны с переносом электронов по транспортным
цепочкам. Наиболее изучены в этом отношении
транспортная цепь митохондрий и хлоропластов.
В
митохондриях электрон-транспортная цепь переносит электроны от НАДН на
кислород. Схема цепи дана ниже:
![]()
Каковы физические
основы переноса электронов по этой цепи Каждый
участник транспортной цепи может быть охарактеризован
окислительно-восстановительным потенциалом (редокс-потенциалом)
- величиной, характеризующей способность вещества принимать электроны. Чем
больше редокс-потенциал, тем сильнее сродство
вещества к электрону.
![]() (5)
(5)
где Е - редокс-потенциал
Е0
- стандартное значение редокс-потенциала
R - газовая постоянная
Т - абсолютная температура
![]() -
число электронов, переносимых от восстановленной формы к
окисленной
-
число электронов, переносимых от восстановленной формы к
окисленной
![]() -
число Фарадея
-
число Фарадея
![]() -
концентрация окисленной формы
-
концентрация окисленной формы
![]() - концентрация
восстановленной формы
- концентрация
восстановленной формы
Физико-химические
справочники содержат значения Е0 для различных веществ при температуре t0 = 20°С. Пара НАД+ /
НАДН имеет Е0 = - 0.32 в,
а пара 1/2 О2 / Н2О имеет стандартный потенциал
равный плюс 0.82. в. Это значит, что при физиологических концентрациях НАД+,
НАДН, О2, и Н2О электроны будут переноситься с НАДН на
кислород, так как окислительно-восстановительный потенциал кислорода значительно
больше, чем потенциал НАДН.
Промежуточные
участники транспорта электронов имеют редокс
потенциалы между - 0.32 в и + 0.82 в.
Таким образом, направленность транспорта электронов задаётся пространственным
расположением участников транспорта и их окислительно-восстановительными
потенциалами.
Соотношение редокс - потенциалов создаёт лишь термодинамические
предпосылки для переноса электронов. Скорость же процесса зависит ещё и от
высоты энергетического барьера, который необходимо преодолеть при переносе
электрона от одного участника к другому.
Обычно
энергия, необходимая для преодоления барьера, доставляется тепловым движением
молекул. Поэтому скорость транспорта увеличивается с температурой в
соответствии с уравнением Аррениуса:
![]() (6)
(6)
где К - константа скорости процесса
К0
- предэкспоненциальный множитель
![]() Е
- энергия активации
Е
- энергия активации
R - газовая постоянная
Т - абсолютная температура
Однако, в некоторых
случаях наблюдается практически независимость скорости переноса электронов от
температуры.. Например, перенос электронов от цитохрома
с к возбуждённой молекуле бактериохлорофилла при
фотосинтезе пурпурных бактерий в диапазоне температур 140 - 4°К
не зависит от температуры. Для объяснения этого явления привлекли теорию туннельного
эффекта.
Суть этого эффекта
состоит в том, что электрон может перейти от донора к акцептору и под энергетическим
барьером, то есть без дополнительной энергии. Эта возможность обусловлена
волновыми свойствами электрона.
Вероятность подбарьерного
перехода тем больше, чем ниже барьер и чем меньше его толщина (то есть, чем
меньше расстояние между донорным и акцепторным
участками). Количественно вероятность туннелирования
описывается формулой Гамова:
![]() (7)
(7)
где р
- вероятность туннелирования сквозь барьер
а
- ширина барьера
![]() Е
- высота барьера
Е
- высота барьера
R - масса электрона
T- постоянная Планка
Например, при а = 1А° и ![]() E
= 1эв получим:
E
= 1эв получим:
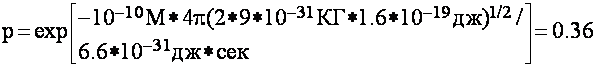
Как видим,
вероятность туннелирования довольно велика. Из
формулы (7) видно, что ширина барьера сильно влияет на вероятность туннелирования. Это значит, что сближение в пространстве
донора и акцептора электронов может существенно увеличивать вероятность туннелирования электронов.
Для
необратимости процесса туннелирования электрона
необходимо, чтобы после перескока электрона на акцептор часть энергии диссипировала в тепло. Следовательно, переносчики электрона
должны обладать такими свойствами, которые обеспечивают необходимую скорость
диссипации электронной энергии в тепло после туннелирования.
Диссипация
электронной энергии в тепло при туннелировании может
обеспечиваться либо взаимодействием электрона с окружающими его молекулами,
либо электронно-колебательными взаимодействиями в молекуле самого переносчика.
Процесс диссипации
электронной энергии в тепло происходит очень быстро - за 10-12 – 10-13сек
(это характерные времена колебания ядер). После того как электрон перешёл на
акцептор и часть электронной энергии диссипировала в
тепло, начинается новый процесс - конформационный
переход к новому равновесному расположению ядер в молекуле акцептора. Этот процесс
занимает гораздо больше времени – 10-3- 10-6 сек.
Причиной конформационного перехода в данном случае
является перенос электрона от донора к акцептору. Поэтому в целом этот процесс
(конформационный переход, вызванный взаимодействием с
электроном) получил название электронно-конформационного
взаимодействия.
Расстояния,
на которые перемещаются ядра при конформационных
переходах, могут достигать нескольких ангстрем.
Каково
функциональное предназначение электронно-конформационных
взаимодействий?
Если бы переносом электрона
от донора на акцептор всё и заканчивалось, то конформационный
переход в молекуле акцептора был бы не нужен. Но электрон должен двигаться
дальше к следующему переносчику. Поэтому необходимо создать условия для перескока
электрона на очередную молекулу акцептроа. Этой цели
и служит конформационный переход в переносчике,
получившем электрон. В результате конформационного перехода
атомные группировки могут перемещаться таким образом, что вероятность перескока
электрона на следующий
переносчик становится большой (например, происходит сближение донорного участка в одной молекуле с акцепторным участком -
в другой).
Таким
образом, конформационные переходы в
белках-переносчиках обеспечивают перенос электрона по цепи, участники которой
фиксированы в мембране.
2.4. ФИЗИЧЕСКИЕ ОСНОВЫ ФЕРМЕНТАТИВНОГО КАТАЛИЗА
Физическая химия
объясняет кинетику химических реакций с использованием понятия активированного
комплекса. Участники реакции образуют комплекс, который затем даёт продукты
реакции. Константа скорости реакции согласно этой концепции записывается в
виде:
![]()
где К - константа скорости реакции
к -
константа Больцмана
Т - абсолютная температура
H - постоянная Планка
![]() - трансмиссионный коэффициент
- трансмиссионный коэффициент
![]() - свободная энергия образования активированного
комплекса
- свободная энергия образования активированного
комплекса
R
- газовая постоянная
Поскольку
![]()
получим
![]()
Экспериментально
установлено, что ферментативный катализ идёт через образование
фермент-субстратного комплекса (ФСК). Субстрат адсорбируется на поверхности
фермента и теряет подвижность, а это означает, что энтропия его уменьшается.
Образование активированного комплекса реагирующими молекулами сопровождается
уменьшением энтропии, так как из двух кинетически независимых частиц образуется
одна.
Переход из
основного состояния в переходное может сопровождаться
как уменьшением энтропии, так и увеличением энтропии. В первом случае внутримолекулярные
движения затормаживаются, в о втором растормаживаются.
Если исходно энтропия ФСК снижена за счёт взаимодействия субстрата с ферментом,
то при переходе в состояние активированного комплекса она при прочих равных
условиях увеличится. Это означает увеличение предэкспоненциального
множителя, и, значит, ускорение реакции.
Другой эффект,
приводящий к ускорению реакции, связан с уменьшением высоты энергетического барьера
на пути реакции, то есть энтальпии активации. Взаимодействие субстрата с
атомными группировками фермента может привести к ослаблению химической связи,
которая должна быть разорвана. Это и значит уменьшение высоты энергетического
барьера. Ослабление связи происходит при смещении электронной плотности за счет
взаимодействия с атомными группировками аминокислотных остатков, образующих активный
центр фермента.
Механизмы
ускорения химической реакции в каждом конкретном случае специфичны. В одном
случае важное значение может иметь энтропийный
член, в другом - энергетический.
При
исследовании механизмов ферментативных реакций используются различные подходы.
В последние годы шире начали использовать молекулярное моделирование ферментов.
Например, интересные результаты получены с использованием каталитических
антител. Субстрат какого-либо фермента модифицируют так, чтобы при его введении
в организм образовывались соответствующие антитела. Затем исследуют каталитические
свойства этих антител с использованием исходного субстрата.
Так, было показано,
что помещение субстрата в гидрофобный карман фермента с низкой диэлектрической
проницаемостью может увеличивать
скорость реакции в 104 раз.