7.3.2. Определение активности
каталазы в мозге
Принцип метода. Смотри методику определения активности каталазы в
крови.
Отбор проб и их хранение. Крыс забивают декапитацией. Вскрывают
череп, быстро извлекают головной мозг и переносят в ледяной раствор 0,9 %-ного хлорида натрия. Через 1–2 мин мозг обсушивают
фильтровальной бумагой, очищают от сосудистой оболочки и на холоде отделяют
кору больших полушарий головного мозга. Из коры больших полушарий в стеклянном
гомогенизаторе готовят 10 %-ный (
Оборудование. Низкоскоростная
центрифуга с охлаждением, центрифуга на 20 000 об./мин с охлаждением, стеклянный гомогенизатор с тефлоновым
пестиком, термостат, колориметр.
Реактивы и их приготовление.
1. 0,9 %-ный раствор хлорида натрия.
2. 4 %-ный водный раствор молибдата
аммония.
3. 0,02 %-ный раствор перекиси водорода.
4. Реактивы
для определения белка по методу Лоури.
Ход определения. Инкубационная среда для определения активности
фермента включает 0,1 мл исследуемого материала и 2 мл 0,02 %-ной перекиси
водорода.
В пробирки разливают
по 2 мл перекиси водорода, предварительно прогревают их до 25 °С. Затем в каждую пробирку вносят по 0,1 мл супернатанта. В контрольную пробирку вместо ферментативного
препарата вносят 0,1 мл бидистиллированной воды.
Пробы инкубируют в течение 10 мин при 25 °С. По истечении
времени реакцию останавливают добавлением 1 мл 4 %-ного
раствора молибдата аммония. Оптическую плотность проб
измеряют при длине волны 410 нм в кювете с длиной
оптического пути 5 мм против воды.
Об активности
каталазы судят по степени уменьшения оптической плотности в опытных пробах (Ео), по сравнению с
контрольной (Ек): DЕ = Ек
– Ео.
Активность
фермента (мкмоль Н2О2/мг
белка/мин) рассчитывают по формуле
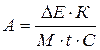 ,
,
где К – коэффициент пересчета единиц оптической плотности
в мг перекиси водорода, рассчитывают по калибровочному графику; М –
молекулярная масса перекиси водорода; t – время реакции, мин; С –
содержание белка в пробе, мг.